Резистентность микробов к антибиотикам
И.Г. Березняков
(Харьковская медицинская академия последипломного образования)
(Резюме и ключевые слова – в конце статьи)
Открытие антибиотиков и внедрение их в клиническую практику стало одним из величайших достижений человечества в уходящем столетии. Антибиотики по праву были названы “чудодейственными лекарствами”, ведь благодаря им спасены миллионы человеческих жизней. К сожалению, в отличие от подавляющего большинства других медикаментов, эффективность антибиотиков с годами снижается. Мир микробов сумел выработать разнообразные механизмы, препятствующие реализации антибактериального эффекта этих лекарств. Другими словами, микроорганизмы способны приобретать устойчивость (резистентность) к действию антибиотиков.
Строго говоря, устойчивость к антибиотикам существовала всегда. До сих пор не был (и едва ли когда-нибудь будет) создан антибиотик, эффективный в отношении всех патогенных бактерий. Так, стенка бактериальных клеток большинства грамотрицательных микробов непроницаема для бензилпенициллина, цефалоспорины и аминогликозиды неэффективны в отношении внутриклеточных (хламидии, легионеллы) и ассоциированных с мембранами (микоплазма) возбудителей и т.д. В подобных случаях говорят о природной, или естественной, устойчивости бактерий к антибиотикам. Возникновение и распространение приобретенной устойчивости обусловлено, главным образом, нерациональным использованием антибиотиков в медицине и сельском хозяйстве.
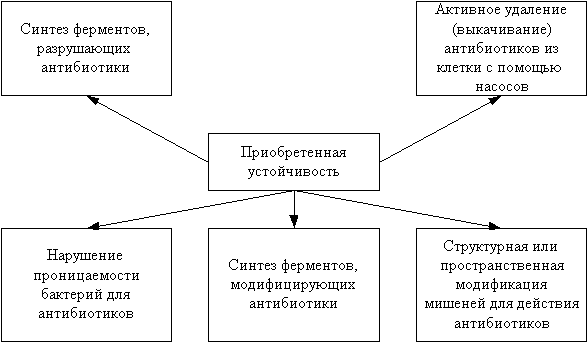
Механизмы, опосредующие приобретенную устойчивость, многообразны (схема 1). Наиболее изученной является способность микроорганизмов синтезировать ферменты, разрушающие антибиотики. Например, ферменты, разрушающие b-лактамные антибиотики, получили название b-лактамаз. Последние представляют собой группу химических соединений, различающихся по ряду параметров: субстратному профилю; спектру действия; строению активного участка, связывающегося с антибиотиками; локализации и типу экспрессии кодирующих генов; чувствительности к ингибиторам (таблица 1). Под субстратным профилем понимают способность к сопоставимому или преимущественному гидролизу тех или иных b-лактамных антибиотиков. Соответственно, различают пенициллиназы, цефалоспориназы, карбапенемазы и т.д. Если гены, кодирующие выработку b-лактамаз, находятся в хромосомах, то начинают распространяться резистентные клоны бактерий. Клоном называется потомство клетки-прародительницы, сумевшей инкорпорировать ген резистентности в свою хромосому, либо приобретшей его в результате мутации. При этом набор генов клеток-потомков, составляющих клон, ничем не будет отличаться от набора генов клетки-прародительницы. Плазмидная же локализация генов, кодирующих выработку b-лактамаз, обусловливает быстрое внутри- и межвидовое распространение резистентности (см. ниже).
Схема 1.
Механизмы приобретенной устойчивости бактерий к антибиотикам

Таблица 1.
Характеристика b-лактамаз
Признак | Детализация |
| Пенициллиназы |
| Цефалоспориназы | |
| Карбапенемазы | |
| Хромосомная | |
| Плазмидная | |
| Сериновый | |
| Цинксодержащий | |
| Широкий | |
| Расширенный | |
| Конститутивный | |
| Индуцибельный | |
| Чувствительные | |
| Нечувствительные |
Границы между хромосомной и плазмидной локализацией генов становятся все более размытыми, поскольку гены, кодирующие выработку b-лактамаз, могут "выскальзывать" в мобильные (подвижные) ДНК и далее перемещаться в плазмиды [1]. Практически все грам-отрицательные бактерии вырабатывают b-лактамазы (гены локализуются в хромосомах). Опосредованные плазмидами b-лактамазы широко распространены не только среди грам-отрицательных микробов, но и у стафилококков [2].
Хромосомные ферменты чаще всего называются по имени вырабатывающего их вида микробов, хотя изредка им присваивается и буквенное наименование (например, тип AmpC). Для названия плазмидных b-лактамаз обычно пользуются шифром, состоящим из трех букв и одной цифры, например, TEM-1, SHV-1 [1].
Среди многочисленных классификаций b-лактамаз наибольшей популярностью пользуется деление ферментов на 4 класса (A, B, C и D). Только ферменты класса B содержат ион цинка в активном участке, взаимодействующем с антибиотиком. b-лактамазы других классов относятся к сериновому типу [3], т.е. содержат в активном участке аминокислоту серин.
Ферменты с расширенным спектром действия в подавляющем большинстве случаев являются мутантами хорошо известных плазмидных b-лактамаз: TEM-1, -2, SHV-1, и, редко, - OXA-2 или -10 [4]. В отличие от "классических", у мутировавших ферментов несколько изменено химическое строение (замещены от одной до четырех аминокислот) и перестроен активный участок. В результате b-лактамазы с расширенным спектром действия способны разрушать не только пенициллины и цефалоспорины 1-го поколения, но и антибиотики, принадлежащие ко 2-му и 3-му поколениям цефалоспоринов [5].
Микроорганизмы могут синтезировать b-лактамазы с постоянной скоростью (конститутивный тип экспрессии кодирующих генов), либо количество образующихся ферментов резко увеличивается после контакта микробов с антибиотиками (индукции). В последнем случае говорят об индуцибельном типе экспрессии. Наконец, синтезируемые бактериями b-лактамазы могут быть чувствительными и нечувствительными к ингибиторам – веществам b-лактамной природы с минимальной собственной антибактериальной активностью, способным необратимо связываться с b-лактамазами и таким образом подавлять их активность (суицидное ингибирование). Плазмидные b-лактамазы грамотрицательных бактерий чувствительны к ингибиторам, а хромосомные – нет. Некоторые хромосомные b-лактамазы грамотрицательных бактерий эффективно гидролизуют практически все b-лактамные антибиотики, включая карбапенемы.
Разрушение антибиотиков с помощью ферментов – не единственный механизм резистентности. Бактерии могут приобретать способность активно удалять (выкачивать) антибиотики из клеток с помощью насосов. Этот механизм характерен, например, для приобретенной устойчивости к тетрациклинам. Классическим образцом резистентности, опосредованной действием подобных насосов, является разветвленная перекрестная устойчивость некоторых штаммов Pseudomonas aeruginosa к b-лактамам, фторхинолонам, тетрациклинам и хлорамфениколу (левомицетину). Долгое время она приписывалась нарушению проницаемости бактерий для этих антибиотиков. В настоящее время установлено, что она связана с опероном MexAmexBopr M, кодирующим систему изгнания указанных средств из микробной клетки [6]. Если инактивировать эту систему, то синегнойные палочки становятся высокочувствительными ко всем перечисленным антибиотикам [7].
Следующий механизм резистентности - нарушение проницаемости бактерий для антибиотиков. Чтобы реализовать свой антимикробный эффект, антибиотики должны связываться с определенными компонентами бактерий, которые являются мишенями для их действия. Для b-лактамных антибиотиков такими мишенями являются "пенициллинсвязывающие белки" (ПСБ) в клеточной стенке бактерий. Они представляют собой ферменты транс- и карбоксипептидазы и катализируют поперечное связывание нитей пептидогликана [8]. Последний играет ключевую роль в формировании каркаса, или остова, клеточной стенки бактерий. Пептидогликан имеет ячеистую (сетевидную) структуру и состоит из нитей полисахарида, связанных между собой поперечными пептидными мостиками. Подавление активности пенициллинсвязывающих белков b-лактамными антибиотиками нарушает образование поперечных связей, что влечет за собой ослабление клеточной стенки микроба и делает его уязвимым для проникновения извне различных веществ. Предполагается, что b-лактамные антибиотики активируют также аутолизины - ферменты, разрушающие клеточные стенки [8,9]. В конечном итоге через "бреши" в клеточной стенке внутрь бактериальной клетки проникают вода, ионы, другие вещества, а микробная клетка набухает и разрывается на части.
У грам-положительных микробов пенициллинсвязывающие белки не прикрываются никакими защитными барьерами. Напротив, у грам-отрицательных бактерий эти белки прикрыты наружной фосфолипидной мембраной. b-лактамы проникают через этот защитный барьер посредством диффузии через поры, которые образуются "пориновыми" белками. Уменьшение числа или радиуса пор сопровождается снижением чувствительности бактерий к антибиотикам. Так, уменьшение экспрессии белка OprD (порина D2) на поверхности некоторых штаммов P. aeruginosa обусловливает устойчивость микробов к имипенему [10]. Эта резистентность узконаправленная и распространяется только на данный карбапенемный антибиотик. Чувствительность указанных микробов к меропенему (другому представителю карбапенемов) также снижается, однако минимальная подавляющая концентрация (МПК) этого антибиотика все же остается в приемлемых для клинического использования пределах [11]. Другой пример резистентности к антибиотикам, обусловленной дефицитом поринов, описан у энтеробактерий. Утрата OmpF и OmpC под воздействием терапии цефокситином привела к появления штаммов микробов с низким уровнем резистентности к цефалоспоринам [12].
Еще один механизм устойчивости связан со способностью микроорганизмов синтезировать ферменты, модифицирующие антибиотики. В результате медикаменты утрачивают возможность связываться со своими мишенями внутри бактериальных клеток и, как следствие, теряют эффективность. Подобный механизм резистентности к аминогликозидам описан у ряда грамотрицательных бактерий кишечной группы, когда антибиотики инактивируются аденилированием, ацетилированием или фосфорилированием.
Резистентность бактерий к антибиотикам развивается и в том случае, если изменяется не антибиотик, а мишень для его действия. Обратимся вновь к b-лактамам. Наибольшим сродством к этим медикаментам обладают пенициллинсвязывающие белки с большой молекулярной массой (ПСБ 1,2,3). Устойчивость бактерий к антибиотикам развивается при:
Если в результате мутации происходит незначительное изменение химической структуры или пространственной организации какого-либо из нормальных ПСБ, то это может вызвать снижение или утрату эффективности некоторых b-лактамных антибиотиков. Именно этот механизм лежит в основе приобретенной устойчивости пневмококков к пенициллину. Низкий уровень устойчивости Staphylococcus aureus к метициллину (МПК антибиотика 4-8 мг/л) в ряде случаев также связан с подобным механизмом. Так, в литературе описаны стафилококки с приобретенной мутацией ПСБ 2, обусловливающей уменьшение его сродства к b-лактамным антибиотикам [13]. Впрочем, такие мутации далеко не всегда оказываются жизнеспособными. Дело в том, что пенициллинсвязывающие белки необходимы для нормального роста и размножения бактерий, а изменения в их структуре могут полностью дезорганизовать жизнедеятельность бактерии и привести к гибели микроорганизма.
Более жизнеспособным оказался другой вариант модификации нормальных ПСБ. Он описан, главным образом, у микробов, способных захватывать свободную ДНК (дезоксирибонуклеиновую кислоту) погибших бактерий. Например, Neisseria flavescens и N. cinerea вырабатывают резистентные к пенициллину ПСБ и могут выступать донорами генов, кодирующих выработку этих белков, для других видов нейссерий - N. meningitidis и N. gonorrhoeae. Последние инкорпорируют фрагменты генов резистентности и включают их в состав собственных ДНК. В результате образуются так называемые "мозаичные" гены, обусловливающие выработку пенициллинсвязывающих белков со сниженным сродством к b-лактамным антибиотикам. Подобный механизм является также одним из факторов устойчивости Haemophilus influenzae к ампициллину, не связанной с выработкой b-лактамаз [14].
Приобретение способности вырабатывать дополнительные ПСБ с низким сродством к b-лактамам лежит в основе появления штаммов S. aureus с высокой устойчивостью к метициллину. Чувствительные штаммы S. aureus для построения клеточных стенок используют нормальные ПСБ 2 и 3. Устойчивые штаммы также сохраняют нормальные ПСБ 2 и 3 в составе своих клеточных стенок, причем эти белки не утрачивают способности связываться с b-лактамными антибиотиками. Однако, в отличие от чувствительных бактерий, резистентные микробы приобрели способность вырабатывать дополнительный белок, получивший название ПСБ 2а. Источник генов, кодирующих выработку этого белка, неизвестен. ПСБ 2а выполняет ту же биологическую роль, что и нормальные ПСБ 2 и 3. Однако, в отличие от последних, для ПСБ 2а характерно низкое сродство ко всем известным b-лактамным антибиотикам, независимо от их химической структуры. В результате резистентные к метициллину штаммы золотистого стафилококка приобрели устойчивость к широкому ряду антибактериальных средств, содержащих b-лактамовые кольца [13].
Чрезмерная выработка нормальных ПСБ (4 и 5) с низким сродством к b-лактамным антибиотикам описана у Enterococcus faecium и S. aureus. Энтерококки приобрели способность вырабатывать большие количества ПСБ 5 в результате мутации. Этот белок и ранее присутствовал у всех видов энтерококков, однако вырабатывался в ничтожных количествах [15]. У ряда штаммов S. aureus низкий уровень устойчивости к метициллину обусловлен чрезмерным образованием ПСБ 4 с меньшим сродством к b-лактамным антибиотикам, чем у ПСБ 1, 2 и 3 [13].
Гены, кодирующие резистентность к антибиотикам, возникают в результате мутаций, либо попадают внутрь микробов извне. Например, при конъюгации устойчивой и чувствительной бактерий гены резистентности могут передаваться с помощью плазмид. Плазмиды – это мелкие генетические элементы в виде заключенных в кольцо нитей ДНК, способные переносить от одного до нескольких генов резистентности. Мир микробов, по образному выражению профессора С. Леви, - это единый многоклеточный организм, клетки которого могут с легкостью обмениваться генетической информацией [16]. Так, плазмиды способны “кочевать” не только среди бактерий одного вида, но и среди микробов разных видов.
Помимо плазмид, гены резистентности могут попадать внутрь бактерий с помощью бактериальных вирусов (бактериофагов), либо захватываться микробами из окружающей среды. В последнем случае носителями генов резистентности являются свободные ДНК погибших бактерий. Впрочем, занос генов резистентности с помощью бактериофагов или захват свободной ДНК, содержащей такие гены, еще не означает, что их новый хозяин стал устойчивым к антибиотикам. Для приобретения резистентности необходимо, чтобы кодирующие ее гены были инкорпорированы в плазмиды или в хромосомы бактерий.
Описанные механизмы отнюдь не исчерпывают тему приобретения и передачи антибиотикорезистентности. Они дают лишь некоторое представление о способности мира микробов приспосабливаться к изменившимся условиям внешней среды и, прежде всего, – к применению антибиотиков.
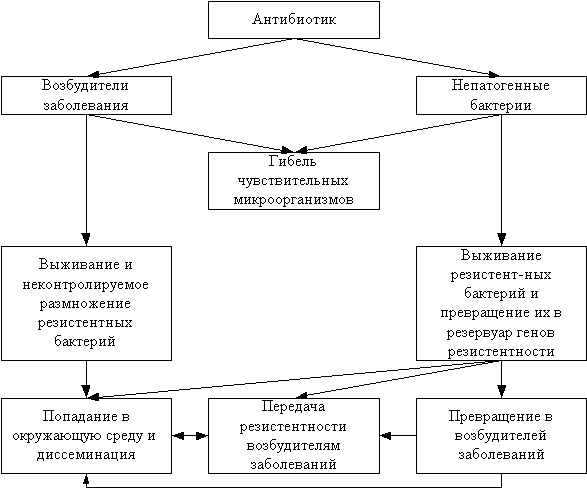
В отличие от подавляющего большинства медикаментов, связывающихся с рецепторами и различными компонентами клеток макроорганизма, для антибиотиков мишенью действия являются микроорганизмы. При этом антибактериальный эффект проявляется как в отношении возбудителей бактериальных инфекций, так и безвредных (и даже полезных) “попутчиков” – микробов-сапрофитов, населяющих в норме кожные и слизистые покровы человека. Другими словами, антибиотики без разбора подавляют рост и размножение всех чувствительных к ним микроорганизмов. В результате выживают только устойчивые штаммы и виды микробов. В естественных условиях неконтролируемое размножение резистентных микробов сдерживается нормальными обитателями человеческого организма, чувствительными к антибиотикам. В общем виде это можно объяснить следующим образом. Во-первых, происходит естественная борьба за существование между разными видами микроорганизмов, конкурирующими за источники питания, среду обитания и т.д. Поэтому количественное преобладание чувствительных к антибиотикам микробов препятствует быстрому размножению микроорганизмов, устойчивых к антибактериальным средствам. Во-вторых, резистентные бактерии вынуждены расходовать энергетические ресурсы на поддержание генов резистентности в “рабочем состоянии”. Это означает, что какая-то часть энергии отвлекается от обслуживания механизмов, обеспечивающих нормальную жизнедеятельность микробов. В результате конкурентоспособность устойчивых к антибиотикам микроорганизмов снижается. Когда же под влиянием антибактериальной терапии чувствительные микробы погибают, резистентные бактерии получают возможность размножаться, не испытывая давления конкурентов. Следовательно, антибиотики вносят свой вклад в селекцию (отбор) резистентных штаммов/видов микробов (схема 2). Происходит это и в том случае, когда антибиотики применяются правильно, и тогда, когда назначение их (либо режим дозирования, доза, длительность терапии и т.д.) не оправданы. Человечество вынуждено мириться с появлением какого-то количества резистентных штаммов/видов микробов, когда антибактериальная терапия проводилась правильно и цель – излечение пациента от бактериальной инфекции – достигнута. Однако нерациональная антибактериальная терапия угрожает появлением огромного числа устойчивых микробов и рано или поздно может лишить человечество одного из его величайших завоеваний – антибиотиков [16].
Резистентными к антибиотикам могут становиться как известные возбудители заболеваний, так и микробы-“попутчики”. К сожалению, жизненный цикл этих бактерий не заканчивается в том макроорганизме, где они впервые появились. Попадая в окружающую среду, они переселяются на других хозяев – начинается диссеминация. Кроме того, микробы-“попутчики” превращаются в резервуар генов резистентности. Впоследствии эти гены могут передаваться другим возбудителям заболеваний, а в некоторых случаях резистентные микробы-“попутчики” сами начинают вызывать болезни. В этом плане примечательна судьба энтерококков и ацинетобактера. Этиологическая роль этих микробов до последнего времени была либо ничтожной, либо нулевой. Сейчас же они стали одними из самых проблемных возбудителей заболеваний.
Схема 2
АНТИБИОТИКИ И СЕЛЕКЦИЯ РЕЗИСТЕНТНЫХ ШТАММОВ/ВИДОВ МИКРООРГАНИЗМОВ
Чаще всего антибиотики применяются для лечения госпитализированных больных. Именно в госпиталях были впервые описаны резистентные штаммы бактерий. В настоящее время в больничной среде (в воздухе, на поверхности медицинского оборудования, в дезинфицирующих жидкостях и т.д.) обитают многие штаммы и виды микробов, приобретшие устойчивость к различным антибиотикам. Каждый стационар имеет дело со своим собственным “букетом” резистентных бактерий, причем внешний вид этого “букета” значительно отличается в разнопрофильных отделениях одной и той же больницы. Чаще всего полирезистентные штаммы микроорганизмов обнаруживаются в отделениях реанимации и интенсивной терапии. В 1995-1996 гг. в отделениях интенсивной терапии в 9 городах России было проведено исследование распространенности грамотрицательных нозокомиальных (внутрибольничных) инфекций и резистентности их возбудителей к антибактериальным средствам [17]. Оказалось, что на долю 6 возбудителей (P. aeruginosa, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Enterobacter spp. и Acinetobacter spp.) приходится 92,5% всех штаммов. Выделенные штаммы были протестированы на чувствительность к 12 антибактериальным препаратам. Если ориентироваться на величины минимальных подавляющих концентраций, то самым эффективным из них оказался ципрофлоксацин, уступавший имипенему и амикацину только в отношении Acinetobacter spp. и не превосходивший имипенем по активности в отношении Klebsiella pneumoniae. В действительности самым эффективным антибиотиком был имипенем, уровень резистентности к которому оказался наименьшим. Ципрофлоксацин же занял в этом списке третье место, уступив не только имипенему, но и амикацину.
Итак, распространению резистентных бактерий во многом способствует неадекватное применение антибиотиков в медицине. Неадекватное использование антибиотиков может быть связано как с врачами (назначение этих медикаментов при вирусных инфекциях и лихорадочных состояниях, не связанных с инфекцией; нерациональная (по длительности, дозировкам, кратности введения, выбору конкретного препарата и т.д.) антибиотикотерапия и др.), так и с пациентами (несоблюдение полного курса антибиотикотерапии, самолечение остатками не употребленных лекарств и т.д.). Однако антибиотики используются не только в медицине. Широкое применение они нашли в сельском хозяйстве и животноводстве, причем не только для лечения и профилактики инфекций, но и в качестве стимуляторов роста (животноводство). В последнем случае они обычно назначаются в субтерапевтических дозах. Можно спорить, насколько такая практика способствует увеличению привеса птицы или мяса, но несомненно то, что подобное применение – прямая дорога к возникновению и распространению резистентных бактерий. Серьезную проблему представляет использование антибиотиков и в сельском хозяйстве. Большие площади, занятые сельскохозяйственными культурами, невозможность индивидуальной обработки каждого больного растения обусловливают использование сельскохозяйственной авиации и других технических средств. В подобных условиях трудно обеспечить адекватные дозировки антибиотиков и избежать попадания медикаментов на соседние участки, засеянные другими культурами. Появление резистентных бактерий выглядит закономерным. Дальнейшее их распространение происходит как среди обслуживающего персонала, так и через пищевую цепочку.
Может ли рациональное использование антибиотиков избавить человечество от угрозы повсеместного распространения резистентных бактерий? Ограничить, свести до разумного минимума – может, а полностью избавить – нет. Следует отдавать себе отчет, что устойчивость к антибиотикам является условием выживания микробов в изменившемся мире.
Существует несколько путей преодоления резистентности бактерий к антибиотикам. Один из них – это защита известных антибиотиков от разрушения ферментами бактерий или от удаления из клетки посредством мембранных насосов. Так появились “защищенные” пенициллины – комбинации полусинтетических пенициллинов с ингибиторами бактериальных b-лактамаз. В нашей стране зарегистрированы комбинации амоксициллина с клавулановой кислотой и ампициллина с сульбактамом. Работы по блокированию насоса, удаляющего тетрациклины из бактериальных клеток, ведутся в лабораториях Тафтского университета (США) [16]. Еще один путь – применение иных антибиотиков выбранной группы. В уже цитированном российском исследовании было показано, что 44% грамотрицательных возбудителей нозокомиальных инфекций устойчивы к аминогликозиду гентамицину, в то время как к другому аминогликозиду - амикацину – оказались резистентными только 4% исследованных микроорганизмов [17]. Перспективными подходами к преодолению резистентности бактерий к антибиотикам представляются также применение комбинаций антибиотиков; проведение целевой и узконаправленной антибактериальной терапии; синтез новых соединений, относящихся к известным классам антибиотиков; поиск принципиально новых классов антибактериальных препаратов.
Литература:
Резюме
В работе рассматриваются основные механизмы приобретения бактериями устойчивости к антибактериальным средствам. На примере b-лактамаз анализируется способность микроорганизмов синтезировать ферменты, разрушающие антибиотики. Структурная или пространственная модификация мишеней для действия антибиотиков как один из механизмов резистентности проиллюстрированы различными изменениями со стороны пенициллинсвязывающих белков. Среди других механизмов резистентности к антибиотикам представлены активное удаление (выкачивание) антибиотиков из клетки с помощью насосов; модификация антибиотиков под влиянием бактериальных ферментов; нарушение проницаемости бактерий для антибиотиков.
Показано, что гены, кодирующие резистентность к антибиотикам, возникают в результате мутаций, либо попадают внутрь микробов извне. В последнем случае переносчиками выступают плазмиды, бактериофаги, либо свободные ДНК погибших бактерий.
Обсуждается роль нерационального использования антибиотиков в медицине, сельском хозяйстве и животноводстве в возникновении и распространении резистентных штаммов и видов микроорганизмов. Очерчены возможные пути преодоления резистентности бактерий к антибиотикам: защита известных антибиотиков от разрушения ферментами бактерий или от удаления из клетки посредством мембранных насосов; применение иных антибиотиков выбранной группы; комбинированная антибиотикотерапия; проведение целевой и узконаправленной антибактериальной терапии; синтез новых соединений, относящихся к известным классам антибиотиков; поиск принципиально новых классов антибактериальных препаратов.
Ключевые слова
Антибиотикорезистентность, бета-лактамазы, мембранные насосы, плазмиды, пенициллинсвязывающие белки.