Бактериемия и сепсис: возбудители и антибиотики
С.В. Сидоренко
Государственный центр по антибиотикам, Москва
Доклад на конференции "Клиническая антибиотикотерапия" (Киев, 22 сентября 1999г.)
В антибактериальной терапии есть две большие крайности. С одной стороны, это группа инфекционных заболеваний, таких, как отит, синусит, которые в 60-70%случаев склонны к полному самоизлечению без использования антибиотиков. А с другой стороны, есть такая патология, как, прежде всего, бактериемия и сепсис, септический шок, когда, несмотря на применение антибиотиков, до 30-40% случаев заканчиваются, к сожалению, летальным исходом.
Как мы на сегодняшний день определяем сепсис? Самым взвешенным, хотя и не раскрывающим всех особенностей патогенеза этого состояния, является так называемое определение североамериканского консенсуса (таблица 1). Сепсис - это системный ответ на инфекцию, проявляющийся системной воспалительной реакцией (СВР), инфекционной природы. Для того чтобы поставить этот диагноз, должно быть не менее двух из четырех приведенных здесь признаков.
Таблица 1.
Сепсис - клинический или микробиологический диагноз?
Определение (североамериканский консенсус)
Естественно, в практической деятельности возникают очень большие сложности. Какие именно? Прежде всего, - что такое сепсис: клинический или микробиологический диагноз? Возможны несколько вариантов (таблица 2).Клиническая интерпретация зависит от микробиологических данных (есть или нет инвазивная инфекция, положительная гемокультура) и наличия тех или иных признаков системной воспалительной реакции.
Таблица 2.
Сепсис - клинический или микробиологический диагноз?
Матрица диагностики (Nystrom, 1998)
| Инвазивная инфекция (положительная гемокультура) | Синдром системной воспалительной реакции (ССВР) | Клиническая интерпретация |
| Отсутствует | Присутствует | ССВР не инфекционной природы. Культурально негативный сепсис |
| Присутствует | Отсутствует | Инфекция без сепсиса |
| Присутствует | Присутствует | Сепсис |
Если получены данные микробиологического исследования об отсутствии инвазивной инфекции (нет гемокультуры), но есть клинические признаки СВР, то можно заключить, что либо это ССВР неинфекционной природы (например, травматический), либо это – культурально негативный сепсис. Такая ситуация, наверное, самая сложная для практического решения. Просто в каждом конкретном случае нужно четко, и, может быть, не особо задумываясь о глубоком патогенезе, принимать одно из этих решений. Если же присутствуют данные о гемокультуре, но отсутствует системная воспалительная реакция, то это просто тяжелая инфекция, но без сепсиса. И, наконец, классический сепсис - когда инвазивная инфекция присутствует, и клинические признаки свидетельствуют о наличии СВР.
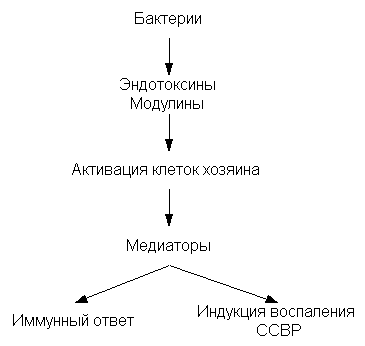
Очень коротко остановимся на роли микроорганизмов в индукции СВР (таблица 3).
Таблица 3.
Микроорганизмы и индукция системной воспалительной реакции

Если раньше говорили в основном о роли эндотоксинов, продуцируемых микроорганизмами, то на сегодняшний день известна достаточно большая группа различных молекул, которые приводят к активации клеток хозяина и выбросу медиаторов. Одна часть медиаторов вызывает индукцию иммунного ответа. Другая же, и о ней пойдет далее речь - занимается индукцией воспаления, индукцией СВР. Это довольно ограниченное число интерлейкинов (IL), так называемых интерлейкинов первой волны, которые вырабатываются буквально в течение нескольких часов: фактор некроза опухолей (TNF), IL-1. Вскоре появляются IL-6 иIL-8. По-видимому, главное, к чему они приводят, - это повышение продукции оксида азота (таблица 4).
Таблица 4.
Медиаторы системного воспаления
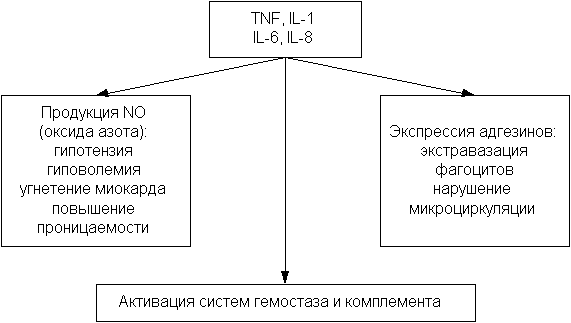
Под влиянием оксида азота развиваются гипотензия и гиповолемия, угнетается миокард, повышается проницаемость кишечника. В общем, возникает та рефрактерная к катехоламинам гипотензия, которая часто наблюдается при септическом шоке, и с которой невозможно справиться никакими лечебными воздействиями. И все это - результат продукции оксида азота.
Под экспрессией адгезивных молекул понимают появление на эндотелии капилляров, на лейкоцитах новых молекул, которые, что называется, "приклеивают" лейкоциты к эндотелию. Это проявляется, причем быстро, экстравазацией фагоцитов, выходом их из сосудистого русла и, соответственно, нарушением микроциркуляции. Эти же интерлейкины активируют систему гемостаза и комплемента и, в конечном счете, развивается септический шок.
Какие же микроорганизмы все это вызывают? Ниже цитируются несколько достаточно объемных исследований. Ни в бывшем Советском Союзе, ни в России, ни, вероятно, на Украине такие обширные исследования не проводились. В первом из них (таблица5) использовался чисто микробиологический подход. Здесь не проводился анализ, когда эти микробы были выделены: при сепсисе или просто при бактериемии без сепсиса, но, в общем, - 5 тысяч случаев - достаточно представительные данные.
Таблица 5.
Микробиология сепсиса и вирулентность возбудителей
(5058 случаев бактериемии) M. Pfaller, 1998
Staphylococcus aureus 22,8%
Escherichia coli 18,8%
Staphylococcus spp. 13,3%
Enterococcus spp. 9,4%
Klebsiella spp. 7,2%
Streptococcus pneumoniae 5,3%
Pseudomonas aeruginosa 4,6%
Enterobacter spp. 3,7%
бета-гемолитические стрептококки 3,6%
Proteus mirabilis 1,5%
Streptococcus "viridans" 1,4%
Acinetobacter spp. 1,3%
Serratia spp. 1,2%
Citrobacter spp. 0,8%
Stenotrophomonas maltophilia 0,8%
P. agglomeratus 0,6%
Salmonella spp. 0,5%
Haemophilus spp. 0,4%
Morganella morganii 0,3%
Corynebacterium 0,3%
Что же бросается в глаза? Микроорганизмы, которые ассоциируются с четкой инфекцией, например, пневмококк - с пневмонией или менингитом, группа зеленящих стрептококков - с эндокардитами, сальмонеллы - с сальмонеллезами, гемофильная инфекция, связанная с менингитами, - все они играют скромную роль. Самая большая доля - у пневмококков (5% случаев), у остальных - от одного до 0,5-0,4% случаев. А основное место занимают золотистые стафилококки, энтерококки, грам-отрицательные микроорганизмы.
Еще одно исследование - даже с большим количеством проанализированных случаев - свыше 13 тысяч случаев нозокомиальной бактериемии (таблица 6).
Таблица 6.
Нозокомиальная бактериемия в Бельгии
1992-1997 гг.
13678 случаев нозокомиальной бактериемии;
40,3% - связана с локальной инфекцией;
23,5% - катетер-ассоциированная;
36,2% - источник не ясен.
* 7,05 эпизода на 10000 пациентов/дней
* 38,5 эпизода на 10000 пациентов/дней в ОИТР (отделениях интенсивной терапии и реанимации)
Roveaux O. et al, 1998
В 40% случаев нозокомиальная бактериемия была связана с локальной инфекцией, в 23% - это катетер-ассоциированная инфекция. И, обратите внимание, в 36%случаев установить источник бактериемии, первичный очаг инфекции, оказалось невозможным. Хотя в исследование привлекались достаточно серьезные микробиологические службы, проводилось детальное клиническое обследование, первичный очаг неизвестен. И еще одно. Средняя частота бактериемии практически в 6-7 раз выше у больных, находящихся в отделениях интенсивной терапии. Впрочем, это не нуждается в комментариях.
Вот еще данные из этого же исследования (таблица 7).
Таблица 7.
Летальность
31,4% - общая летальность;
49,3% - летальность при легочной локализации первичного очага.
Этиология
Staphylococcus spp. (коагулазонегативные) - 22,0%;
Staphylococcus aureus - 14,1%;
Escherichia coli - 13,5%.
Roveaux O. et al, 1998
Если 31% - это общая летальность, в том числе при бактериемии, то при легочной локализации первичного очага она достигает почти 50%. И этиология. Вновь - стафилококки - и золотистые, и коагулазонегативные, а также, кишечная палочка.
Если просуммировать данные об этиологии, то что же получится? С одной стороны - два возбудителя, т.е. немножко больше, конечно, - все стафилококки, как род, и кишечная палочка - это 50% (таблица 8).
Таблица 8.
Возбудители сепсиса - компоненты микробной флоры человека
| Staphylococcus spp. + Escherichia coli = 50% | Дыхательные пути: |
| |
+ |
|
| Enterococcus spp. + Klebsiella spp. + Pseudomonas aeruginosa + Enterobacter spp. + бета-гемолитические стрептококки = 30% |
|
| |
| |
| |
| |
| |
| ЖКТ (желудочно-кишечный тракт): | |
| |
| |
| |
| |
| |
| Итого: 80% |
|
Если к ним добавить энтерококков, стрептококков, грам-отрицательных микробов, то получается уже 80%. Откуда же человек инфицируется?
У больных, особенно инфекционных, это, все-таки, всегда - эндогенная флора. Для сравнения в таблице представлен крайне ограниченный список микроорганизмов дыхательных путей и желудочно-кишечного тракта. В действительности он намного разнообразнее и включает десятки, сотни и многие тысячи видов микробов, локализованных на слизистых желудочно-кишечного тракта и дыхательных путей. А реальную инфекцию вызывает весьма ограниченное количество видов микроорганизмов. Спрашивается, почему? Видимо, существуют какие-то факторы, которые на это влияют.
Выше уже отмечалось, что на сегодняшний день выделяют ряд компонентов микробной клетки, которые способны непосредственно, напрямую, вызывать образование так называемых провоспалительных цитокинов - IL-1, IL-6, фактора некроза опухолей, т.е. запускать ССВР. В таблице 9 представлена их относительная, либо потенциальная воспалительная активность.
Таблица 9.
Компоненты микробной клетки и индукция провоспалительных цитокинов IL-1, IL-6, TNF
| LPS (липополисахарид) | от 0,01 до 100 нг/мл | |
| Порины | гр- | 10 нг/мл |
| Белки ворсинок | гр- | 10 нг/мл |
| Липопротеины | гр-/гр+ | 0,5 нг/мл |
| Гликопротеины | гр-/гр+ | 0,05 нг/мл |
| Липиды | гр-/гр+ | 0,1 нг/мл |
| Пептидогликан | гр-/гр+ | 100 нг/мл |
| Поверхностные белки | гр+ | 0,01 нг/мл |
| Тейхоевые кислоты | гр+ | 1000 нг/мл |
Henderson B. et al., 1996
Прежде всего, это, конечно, липополисахарид. Из таблицы видно, что у всех грам-отрицательных микробов отмечается колоссальный разброс по способности индуцировать образование, прежде всего, фактора некроза опухолей: от одной сотой нг/мл у некоторых микроорганизмов до более чем 100 нг/мл - у других.
Пориновые белки, которые локализованы в клеточной мембране грам-отрицательных бактерий, и белки ворсин тоже обладают достаточно высокой способностью индуцировать провоспалительные цитокины.
Липопротеины, гликопротеины, липиды, пептидогликан есть и у грам-отрицательных, и у грам-положительных бактерий. Все они – компоненты клеточной стенки. Специфические поверхностные белки встречаются только у грам-положительных микробов.
Очевидно, что потенциал по индукции провоспалительных цитокинов у грам-положительной микрофлоры значительно ниже. Например, концентрация тейхоевых кислот, необходимая, чтобы вызвать индукцию фактора некроза опухолей, составляет 1000 нг/мл. С чем все это связано?
Каковы основные факторы, которые действительно приводят к синтезу провоспалительных цитокинов у грам-положительной флоры? Прежде всего, это, конечно, поверхностные структуры (таблица 10).
Таблица 10.
Грам-положительные микроорганизмы в этиологии бактериемии и сепсиса Staphylococcus spp., Streptococcus spp., Enterococcus spp.
Поверхностные структуры:
Функции:
Микроорганизм адаптирован к тому, чтобы развивать патологическую реакцию в организме человека, и между организмом человека и микробом идет постоянный диалог. Конечно, постоянный диалог идет, в основном, за счет поверхностных структур. Это белки, связывающиеся с иммуноглобулинами, и большая группа белков, распознающих внеклеточный матрикс, т.е., те белки, которые позволяют микроорганизмам прикрепляться к внеклеточному матриксу, межклеточным пространствам в организме человека. К поверхностным структурам относится и ряд поверхностных ферментов. Для чего микробам столько поверхностных структур? Для того чтобы связаться с тканями и компонентами иммунной системы, чтобы обеспечить поступление питательных веществ внутрь клетки и, если нужно, вызвать агрегацию микробных клеток.
В таблице 11 представлены сведения о самых частых возбудителях системной и госпитальной инфекции - стафилококках.
Таблица 11.
Адгезивность стафилококков
Важный фактор адгезивности стафилококка, способствующий его прикреплению, - это белок А. Он способен непосредственно связываться с иммуноглобулинами сыворотки человека, причем независимо от их специфичности. Этот микроб, стафилококк, связывается с любым иммуноглобулином благодаря наличию данного белка. Продукция факторов, обеспечивающих связывание с внеклеточным матриксом, усиливается, что интересно, при низкой плотности культуры. Образно говоря, когда стафилококк плавает в крови, в сосудистом русле, или он попал в сосудистый катетер, то, при низкой плотности культуры микроб начинает интенсивно вырабатывать факторы, которые способствуют его прикреплению и формированию биопленки. Это - коллаген-связывающий белок, фибронектин-связывающий белок, фибриноген-связывающий белок. То есть, на поверхности микроба имеются, условно говоря, рецепторы, которые позволяют ему "уцепиться" за какие-то фрагменты в организме человека. Связывание с белками плазмы усиливается протеолитическими ферментами.
Что можно сказать о той роли, какую играет токсинообразование стафилококков? Показано, что стафилококк в определенной степени способен к инвазивности. Ранее полагали, что это - малопатогенный микроорганизм, живущий только на поверхности. Оказалось, что он способен инвазировать эндотелий. Причем непосредственно сам факт инвазии вызывает индукцию цитокинов (таблица 12).
Таблица 12.
Инвазивность стафилококков?
Токсинообразование S. aureus
Стафилококковые токсины (а это - энтеротоксин, токсин синдрома токсического шока, эксфолиативный токсин), - также напрямую стимулируют образование различных провоспалительных цитокинов. Все перечисленные стафилококковые токсины - это суперантигены. Они напрямую стимулируют Т-лимфоциты, без необходимости кооперации с макрофагами, без процессинга антигена. Все вместе это еще более усиливает развитие синдрома СВР.
В последние годы резко возросла актуальность инвазивных стрептококковых инфекций, вызванных пиогенным стрептококком. Основную, наверное, функцию у пиогенных стрептококков играет большая группа поверхностных полифункциональных белков, так называемых белков семейства М (таблица 13). В действительности их очень много. Что же они делают?
Таблица 13.
Streptococcus pyogenes. Тенденция к росту инвазивных стрептококковых инфекций
Полифункциональные белки семейства M [Emm, Enn, M]
С одной стороны, они обладают выраженной антифагоцитарной активностью. Они снижают связывания с C 3b компонентом комплемента, предотвращают опсонизацию. Ас другой стороны, они обладают явной провоспалительной активностью. Белки семейства М напрямую, связываясь с кининогеном, плазминогеном, фибриногеном, с внеклеточным матриксом, осуществляют инвазию глубоких тканей и местный воспалительный ответ. То есть, эти структуры, которые находятся на поверхности стрептококка, обеспечивают инвазию и вызывают воспалительную реакцию. Белки семейства М подвержены значительной вариабельности за счет межвидовой передачи генетического материала.
Какие еще есть факторы вирулентности у стрептококка? Это так называемая C 5a-пептидаза (таблица 14). Она разрушает C 5a-фрагмент комплемента и предотвращает хемотаксис.
Таблица 14.
Другие факторы вирулентности S. pyogenes
C 5a-пептидаза
Энтерогенный токсин А
Enterococcus spp.
Нейтрофилы не двигаются в ту сторону, где локализована стрептококковая инфекция. Микроб оказывается защищенным. В то же время, энтерогенный токсин А напрямую индуцирует синтез все тех же провоспалительных цитокинов. Но самый на сегодняшний день сложный для понимания микроб, - это, конечно, энтерококк. Доля его в инфекциях достаточно высока, однако микробиологам до сих пор не удалось найти у энтерококка ни одного реального фактора вирулентности. Не удается выявить ни одного белка, который бы вызывал реальное повреждение в организме человека, вызывал бы воспалительный процесс.
До сих пор речь шла о грам-положительных микробах. Другой актуальный возбудитель - это кишечная палочка. Среди всех микроорганизмов кишечная палочка характеризуется крайней вариабельностью (таблица 15).
Таблица 15.
Вариабельность E.coli
Известны штаммы, тропные к:
Причины:
Известны штаммы, тропные к мочевыводящим путям, центральной нервной системе, вызывающие диарею, в том числе сопровождающуюся гемолитико-уремическим синдромом. В чем причина такой вариабельности? Кишечная палочка обладает крайне высоким потенциалом к генетическому обмену, как межштаммовому, так и обмену с родственными микроорганизмами - шигеллами, сальмонеллами, иерсиниями. Осуществляется это с помощью плазмид, бактериофагов, транспозонов.
Очень важный вопрос, - какие факторы грам-отрицательных бактерий обеспечивают стимуляцию продукции провоспалительных цитокинов? Прежде всего, это, конечно, липополисахарид. Выше отмечалось, что именно он обладает самой высокой способностью вызывать продукцию цитокинов. Как только микроб начинает осуществлять инвазию в клетки эпителия, сразу начинается выработка и продукция цитокинов. А вообще, существует очень много механизмов, благодаря которым микробы осуществляют непосредственную реакцию (таблица 16). Так, у синегнойной палочки факторами вирулентности являются эластаза, гемолизин, пиоцианин, экзотоксин А.
Таблица 16.
Стимуляция продукции провоспалительных цитокинов
Escherichia coli, Pseudomonas aeruginosa
Стимулы:
Факторы вирулентности Pseudomonas aeruginosa:
Что еще важно для понимания на современном этапе патогенеза септических состояний? В грам-отрицательных микроорганизмах на сегодняшний день четко определяется существование таких факторов, как островки патогенности (таблица17).
Таблица 17.
Патогенность Escherichia coli, Pseudomonas aeruginosa
Островки патогенности - это комплекс генов, локализованных на хромосомной основе и кодирующих факторы, подавляющие защитные реакции хозяина. Они, эти факторы, подавляют синтез белка в клетках человека, пролиферацию клеток человека, секрецию ионов, транскрипцию ДНК. Они индуцируют апоптоз, или программируемую смерть. Все эти факторы записаны в маленьком островке патогенности, который достаточно легко мигрирует от одного микроба к другому.
Плазмиды вирулентности кодируют гены ворсинок и гемолизина.
В последние годы, в основном, удалось расшифровать те системы, в результате которых в лаборатории (на чашке) можно не наблюдать экспрессию факторов вирулентности, однако при попадании инфекционного агента в организм человека он (микроб) становится вирулентным. Это очень тонкий механизм регуляции. Выше уже отмечалось, что на поверхности клеток микроорганизма существуют специальные рецепторы. Как только поступает внешний сигнал (а это - контакт с эпителием организма человека), запускается достаточно сложная система ферментативных реакций, которая приводит к тому, что все факторы вирулентности начинают экспрессироваться заново.
Таким образом, микроб ведет себя очень экономично. Пока он находится во внешней среде или на чашке, он не синтезирует те факторы, которые ему нужны, для того чтобы жить в организме человека. Как только произошел этот контакт, начинается синтез факторов вирулентности с островков патогенности. Существуют специальные системы секреции протеидов (и у синегнойной, и у некоторых штаммов кишечной палочек), которые по типу шприца впрыскивают в клетку, в эукариотическую клетку человека, факторы вирулентности, приводящие к ее гибели.
Кроме такой вот тонкой регуляции, есть еще одна система регуляции, крайне важная с практической точки зрения. Оказывается, микроорганизмы могут регулировать экспрессию своей вирулентности на популяционном уровне. Описано такое явление, как quorum sensing. На русский язык его, наверное, лучше всего перевести как "феномен кооперативной чувствительности" (таблица 18). Он заключается в синхронизации ответа микробной популяции на условия внешней среды. Медиаторами являются N-ацил гомосерил лактоны. При достижении в окружающей среде определенной плотности (концентрации) медиатора происходит индукция синтеза факторов вирулентности.
Таблица 18.
Регуляция вирулентности Pseudomonas aeruginosa на популяционном уровне
Quorum sensing - кооперативная чувствительность
Медиаторы
Механизм
Когда синегнойная палочка, или кишечная палочка, вызывает небольшой поверхностный раневой процесс, индукции синтеза факторов вирулентности не происходит. Но как только микроорганизм "чувствует", что его уже накопилось много, тогда, в результате действия этих медиаторов, происходит начало синтеза и выработки факторов вирулентности, и состояние больного резко утяжеляется. Происходит как бы переход количественных изменений в качественные: микроба еще не видно, а состояние больного резко утяжелилось. Таким вот образом микробы ведут себя на уровне популяции: они "чувствуют" друг друга и "чувствуют" человека.
Как в этой ситуации быть с антибиотиками? Как антибиотики влияют на продукцию бактериальных модулинов? Достаточно давно утвердилось мнение, что лизис бактерий сопровождается высвобождением эндотоксинов. Насколько это имеет клиническое значение? Десятки лет известна реакция Джариша-Герксгеймера, сводящаяся к тому, что при начале лечения сифилиса пенициллином происходит лизис бледных трепонем и у больного повышается температура тела. В ее основе - выброс тех самых токсических субстанций. Имеет ли это место в реальной клинике? Вспомним, как нас учили. Нам всегда говорили, что если имеет место тяжелая инфекция, то начинать надо с бактериостатических антибиотиков. Не дай Бог произойдет лизис бактерий, выброс токсических субстанций, и больному станет хуже. Что же за этим стоит и стоит ли за этим вообще что-то?
На примере грам-отрицательных бактерий рассмотрим самую распространенную группу - бета-лактамные антибиотики (таблица 19).
Таблица 19.
Антибиотики и продукция бактериальных модулинов
Основными мишенями действия бета-лактамных антибиотиков являются так называемые высокомолекулярные пенициллин-связывающие белки (ПСБ). Когда бета-лактамный антибиотик связывается с белком номер 1 (ПСБ 1), наступает быстрый бактерицидный эффект. Микроб погибает сразу - без всяких внешних морфологических изменений. Он, если так можно выразиться, перед смертью "не бледнеет, не краснеет".
При угнетении ПСБ 2 микроорганизмы образуют сферопласты, которые становятся осмотически неустойчивыми и также достаточно быстро гибнут. То есть, довольно быстрый бактерицидный эффект. Если же антибиотик связывается с ПСБ 3, то в течение какого-то времени продолжается рост, но угнетается деление.
Как в этом случае выглядят микроорганизмы? Грам-положительные и грам-отрицательные микробы выглядят в этом случае немножко по-разному. Если антибиотик действует преимущественно на ПСБ 3, то грам-положительные микроорганизмы образуют округлые конгломераты внутри клеточной стенки; разделение, однако, при этом не происходит. Грам-отрицательные микробы выстраиваются в длинные филаменты - до 50-70 неразделенных клеток.
Эти морфологические эффекты были известны уже давно - лет 15-20. По существу, действительно, получаются полигеномные формы. У каждой из этих клеточек есть геном, но они не разделились. И что очень важно - идет постоянное утолщение внешней мембраны. То есть все те вещества, о которых речь шла выше: токсические субстанции, бактериальные модулины, - они продолжают вырабатываться. И в этой ситуации, естественно, потенциал микроорганизма, обработанного антибиотиком, по способности индуцировать провоспалительные цитокины, резко возрастает.
В определенной степени бета-лактамные антибиотики можно, действительно, разделить по тому, как они действуют на отдельные белки (таблица 20). Карбапенемные антибиотики, цефтриаксон из группы цефалоспоринов III-го поколения, цефалоспорин IV-го поколения цефепим одновременно подавляют ПСБ 1 и ПСБ 2. Наступает быстрый бактерицидный эффект.
Таблица 20.
Эффекты бета-лактамных антибиотиков
Карбапенемы, цефтриаксон, цефепим
Азтреонам, уреидопенициллины
Цефуроксим, цефтазидим
Periti P., 1999
Азтреонам и уреидопенициллины подавляют преимущественно ПСБ 3. И что очень важно - рост микробов может продолжаться при концентрациях, превышающих минимальную подавляющую концентрацию (МПК) в 512 раз. Это чрезвычайно высокие концентрации. Но рано или поздно, микроорганизм все-таки гибнет. И вот когда гибнет либо филаментозная, либо конгломератная структура, тогда и происходит массивное, причем в очень высокой степени, высвобождение медиаторов воспаления.
Другая группа антибиотиков - а это большинство цефалоспоринов II-го и III-го поколений - также подавляет преимущественно ПСБ 3. Но рост микробов продолжается только при небольших концентрациях - порядка 16 МПК - и микроб уже гибнет. То есть, вероятность высвобождения большого количества бактериальных липополисахаридов, гематуринов резко снижается. Каковы отсюда практические выводы?
Гипотезу о том, что основную роль в развитии неблагоприятных осложнений в последние годы активно отстаивает P. Periti. Какие же практические выводы он делает? Во-первых, для терапии сепсиса целесообразно использовать антибиотики, в наименьшей степени провоцирующие развитие септического шока (таблица 21). То есть, если антибиотик бактерицидный, это еще не означает, что микроорганизм будет провоцировать септический шок. Во-вторых, антибиотики, вызывающие образование аберрантных форм, целесообразно использовать в максимальных дозах или в комбинации с другими бактерицидными препаратами. Иначе микроорганизм продолжает нарабатывать субстанции, провоцирующие шок.
Таблица 21.
Практические выводы (1)
Какой следующий практический вывод? Очевидно, что сам по себе бактерицидный эффект не сопровождается значимым высвобождением модулинов и не провоцирует септический шок (таблица 22). Из бактерицидных антибиотиков предпочтительны обладающие наименьшей способностью провоцировать развитие токсического шока. Для тех же антибиотиков, которые вызывают шок, имеет значение замедление бактерицидного действия при продолжении роста клеточной стенки микроорганизма. Поэтому необходимы антибиотики, которые бы резко усиливали скорость наступления бактерицидного эффекта и не позволяли микроорганизмам наработать большее количество токсических субстанций.
Таблица 22.
Практические выводы (2)
Таким образом, на сегодняшний день антибактериальная терапия бактериемии и сепсиса, несмотря на наличие большого количества высокоэффективных препаратов, сталкивается со многими сложностями.
Действительно, не все эти наблюдения находят однозначное подтверждение в клинической практике. Большинство данных получены экспериментальным путем, но есть и некоторые клинические наблюдения, связывающие повышение образования токсических субстанций, бактериальных модулинов, с ухудшением состояния больных. Как это действует на летальность, оценить довольно сложно, но очевидно, что в повседневной практике хирургов и реаниматологов, сталкивающи