АКТУАЛЬНЫЕ ВОПРОСЫ ПАТОГЕНЕЗА И ЛЕЧЕНИЯ СЕПСИСА
В.Б. Белобородов
Российская медицинская академия последипломного образования, Москва
Доклад на конференции “Клиническая антибиотикотерапия” (Киев, 5 октября 2000 г.)
Проблема сепсиса динамично развивается, а в последние десять лет отмечается небывалый интерес к этому заболеванию как за границей, так и в России. В 1999 г. вышло более 2 тыс. публикаций, посвященных сепсису. Так, на прошедшем недавно Съезде анестезиологов и реаниматологов Российской Федерации была представлена новая книга профессора А.Л. Костюченко и соавторов “Интенсивная терапия сепсиса и тяжелых инфекций”. Всем известна его монография “Септический шок”, вышедшая в 1981 г., которая стала настольной книгой не только для ученых, занимающихся этой проблемой, но и для анестезиологов, реаниматологов, хирургов и врачей других специальностей, сталкивающихся с тяжелыми инфекциями.
Настоящее сообщение является обзором наиболее важных современных данных, касающихся проблем патогенеза, диагностики и лечения сепсиса. В результате быстрого развития знаний в этой области меняется представление о роли отдельных факторов в патогенезе и лечении сепсиса. Тем не менее, существует определенный консенсус, позволяющий излагать современное положение вещей по данному вопросу. Проблема сепсиса очень многогранна. В действительности — это комплекс проблем, включающий патогенез собственно тяжелых инфекций, патогенез полиорганной недостаточности, антибактериальную терапию, методы временного органозамещения, интенсивную терапию неотложных состояний и плюс ко всему проблема сепсиса, по моему мнению, является проблемой организации работы врачей. Она требует комплексного взаимодействия врачей различных специальностей и не может быть решена в рамках одной профессии. На сегодняшний день нам кажется оптимальным создание коллектива, подобного тому, в котором мы работали последние пять лет на базе четырех отделений реанимации и интенсивной терапии больницы имени С.П. Боткина в Москве.
Актуальность проблемы сепсиса определяется:
В настоящее время точное число заболевших сепсисом в мире неизвестно. В США, где система контроля инфекций налажена удовлетворительно, в год регистрируют от 300 000 до 500 000 случаев этого заболевания.
В среднем летальность от сепсиса составляет 50%. Прослеживается четкая ее зависимость от контингента больных. Самая высокая летальность отмечена среди пациентов с абдоминальным сепсисом — 72%. У нас накоплен значительный собственный опыт работы с больными септическим шоком менингококковой этиологии. При фульминантной менингококкцемии с полиорганной недостаточностью летальность достигала 92%, хотя летальность среди больных с менингококковой инфекцией в отделении реанимации не превышала 13%, а общая летальность при этой патологии — 3%.
Затраты, связанные с лечением сепсиса, в разных странах самые различные, и их очень трудно сравнивать. В среднем в странах Европы лечение одного случая сепсиса стоит от $8000 до $27 000, в США — до $81 000. В последующем больным может потребоваться реабилитационное лечение в течение года, затраты на которое могут достигать $250 000. В США на проблему сепсиса тратится порядка $4 млрд в год.
Эпидемиологические данные позволяют отметить некоторые структурные изменения, связанные с проблемой сепсиса:
Одним из наиболее сложных для лечения и протекающих в тяжелой форме является сепсис, вызванный Pseudomonas aeruginosa. Летальность больных сепсисом данной этиологии очень высока. Она обусловлена, во-первых, высокой резистентностью возбудителя к широкому спектру современных антибактериальных препаратов, во-вторых, тем, что сепсис развивается у пациентов, которые уже находятся на стационарном лечении с тяжелым острым или хроническим заболеванием.
К факторам, способным оказать влияние на исход заболевания, относятся:
В мире существует общая тенденция к повышению среднего возраста пациентов. Возраст является важным фактором, потому что у пожилых больных, как правило, имеется несколько хронических заболеваний. Кроме того, среди них есть лица с иммунологическими нарушениями, возникшими в результате лечения онкологических (хирургическое лечение, химиотерапия, рентгено/радиологическое лечение) и хронических воспалительных заболеваний (кортикостероидные гормоны). То есть формируется пул людей или группа больных, у которых существует высокая вероятность развития сепсиса. Кроме того, у пожилых людей в результате возрастных изменений нарушается функция лимфоцитов-хелперов, которые распознают возбудителей инфекционных заболеваний, что также увеличивает вероятность возникновения у них сепсиса. Естественно, у пациентов пожилого возраста тяжесть состояния во многом определяется сопутствующими хроническими заболеваниями.

Очень важную роль в исходе сепсиса играет тяжесть состояния пациента в момент госпитализации. Развитие полиорганной недостаточности на догоспитальном этапе существенно повышает вероятность неблагоприятного исхода заболевания. В стационаре важную роль играет своевременное выявление признаков полиорганной недостаточности и септического шока. Существуют данные литературы о том, что развитие септического шока в отделении общего профиля — хирургическом, урологическом или терапевтическом — приводит к увеличению летальности в 2 раза, по сравнению с развитием такого же септического шока в отделении реанимации и интенсивной терапии. Это связано с тем, что в отделении реанимации и интенсивной терапии существуют условия для мониторинга и раннего выявления органной дисфункции и недостаточности, в то время как возможности отделений общего профиля в этом плане ограничены.
Увеличение продолжительности стационарного лечения связано с опасностью развития нозокомиальной инфекции. В среднем продолжительность пребывания больного в стационаре в США в настоящее время составляет 4,5 сут. Это очень хороший показатель, потому что чем меньше продолжительность стационарного лечения, тем меньше вероятность контакта с возбудителями нозокомиальной инфекции. Кратковременность стационарного лечения — это позитивное изменение качества оказания медицинской помощи.
Наличие онкологических заболеваний и нейтропении — это косвенные признаки иммунологической недостаточности, указывающие на нарушение контроля внутренней среды организма и нарушение нормальных фагоцитарных реакций.
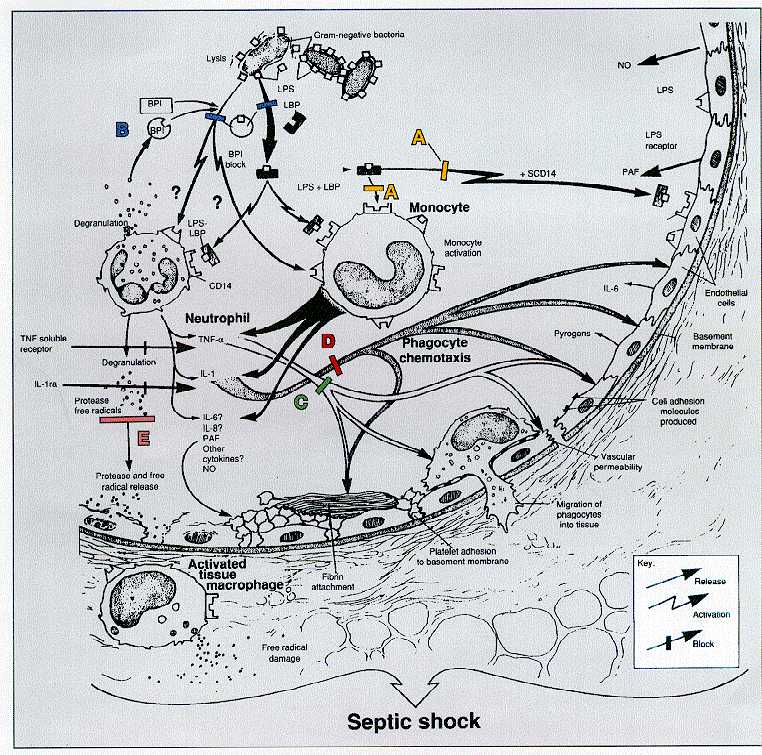
Патогенез сепсиса и септического шока представлен на рисунке.
Патогенез сепсиса и септического шока
Hiddemann W. Introduction. New aspects in the treatment of septic shock.
Antiinfective drugs and chemotherapy. 1995; 13(2):113—114
Lysis — лизис
Gram-negative bacteria — грамотрицательные бактерии
LPS — липиполисахарид
LBP — липополисахаридсвязывающий белок
BPI — фактор, повышающий проницаемость бактериальной стенки
BPI block — блокада фактора, повышающего проницаемость бактериальной стенки
Degranulation — дегрануляция
CD 14 — рецептор CD-14 на поверхности моноцитов/макрофагов, эндотелиальных клетках и нейтрофильных гранулоцитов
TNF soluble receptor — растворимый рецептор фактора некроза опухолей (ФНО)
IL-1ra — растворимый рецептор интерлейкина-1
Protease free radicals — свободные радикалы протеаз
Protease and free radicals release — высвобождение протеаз и свободных радикалов
Activated tissue macrophage — активированный тканевой макрофаг
Free radical damage — свободнорадикальное повреждение
Neutrophil — нейтрофильный гранулоцит
TNF-? — ?актор некроза опухолей альфа
IL-1, -6, -8 — интерлейкин-1, -6, -8
Other cytokines — другие цитокины
NO — оксид азота
Fibrin attachment — прикрепление фибрина
Monocyte — моноцит
Monocyte activation — активация моноцитов
SCD 14 — растворимый рецептор SD-14
Phagocyte chemotaxis — хемотаксис фагоцитов
Platelet adhesion to basement membrane — адгезия тромбоцитов к базальной мембране
Septic shock — септический шок
LPS receptor — рецептор липополисахарида
PAF — фактор активации тромбоцитов
Endothelial cells — эндотелиальные клетки
Pyrogens — пирогены
Basement membrane — базальная мембрана
Cell adhesion molecule produced — вновь образованные молекулы адгезии клеток
Vascular permeability — сосудистая проницаемость
Migration of phagocytes into tissue — миграция фагоцитов в ткань
Key — ключ
Release — высвобождение
Activation — активация
Block — блокада
Буквами обозначены перспективные пути ингибирования воспалительной реакции, вызванной цитокинами. A – введение пациентам растворимых рецепторов CD-14 для снижения связывания LPS+LBP (комплекса липополисахарида с липополисахаридсвязывающим белком) с рецепторами CD-14.
B - введение фактора, повышающего проницаемость бактериальной стенки - он имеет высокую аффинность к LPS и LPS+LBP, связывает их и предотвращает взаимодействие с CD-14.
С - это введение антител к TNF (фактору некроза опухолей-альфа), связывание TNF и
предотвращение его связывания с тканевыми рецепторами - снижение активации
клеток органов-мишеней.
D - введение растворимых рецепторов интеерлейкина-1 (IL-1ra) с
той же целью, что и в предыдущем пункте.
E – методы, способные снижать активность протеаз и свободных радикалов (на рисунке не указаны, предположительно речь идет об ингибиторах протеолитических ферментов и препаратах на основе витамина E).
Патогенез сепсиса, вызванного грамотрицательной микрофлорой, к настоящему времени изучен сравнительно лучше, чем патогенез сепсиса, вызванного грамположительными микроорганизмами. Пусковым “механизмом” является грамотрицательная бактерия. Внешний слой оболочки грамотрицательных бактерий составляет биологический полимер — липополисахарид (ЛПС — эндотоксин). Он прикрепляется к бактериальной клетке с помощью липида А, среднюю часть составляет КОР, а с внешней стороны клетки располагается так называемый О-антиген. Существуют данные лабораторных и клинических исследований, подтверждающие важную роль ЛПС в патогенезе инфекций, обусловленных грамотрицательными микроорганизмами. Концентрация ЛПС в крови при ряде инфекций определяет прогноз заболевания: при менингококковой инфекции, некоторых инфекционных заболеваниях, вызванных грамотрицательными возбудителями. Образование свободного ЛПС происходит вследствие роста грамотрицательных бактерий и их разрушения (в результате фагоцитоза, применения антибактериальных препаратов). Активность ЛПС в виде фрагментов бактериальной клетки примерно в 40 раз ниже, чем чистого ЛПС, полученного в результате специальной обработки. При попадании в кровь ЛПС соединяется с так называемым ЛПС-связывающим белком. Этот комплекс — ЛПС+ЛПС-связывающий белок — взаимодействует с рецептором CD-14 на поверхности моноцитов/макрофагов, эндотелиальных клеток и нейтрофильных гранулоцитов. При взаимодействии комплекса с рецептором происходит активация клеток. Активация макрофагов приводит к синтезу белков — провоспалительных цитокинов, которые через 30 мин появляются в связанной с клетками форме на их поверхности. Потом часть из них в результате ограниченного протеолиза освобождается и попадает в кровоток. В центре патогенеза сепсиса, по современным представлениям, находится моноцит/макрофаг. В экспериментальных исследованиях на животных и исследованиях, проведенных с участием добровольцев, показано, что внутривенное введение провоспалительных цитокинов вызывает реакцию, которая по клиническим и лабораторным показателям не отличается от таковой при тяжелой инфекции и сепсисе. С помощью внутривенного введения генноинженерного фактора некроза опухоли и интерлейкина-I можно искусственно моделировать различные проявления сепсиса — дозозависимую лихорадку, сонливость, отсутствие аппетита, разбитость, мышечную слабость, лейкоцитоз, повышение концентрации белков “острой фазы” в крови. То есть, в настоящее время выявлены конкретные вещества, способные без участия бактерий вызывать клинические и лабораторные признаки генерализованной инфекции.
Другим важнейшим элементом патогенеза сепсиса является активация эндотелиальных клеток, в результате которой они изменяют свою форму — из плоских становятся выпуклыми, на их поверхности экспрессируются молекулы адгезии. В результате изменения формы клеток открываются зоны плотных межклеточных контактов, что обусловливает развитие синдрома повышенной сосудистой проницаемости. Активация эндотелиоцитов происходит не везде одновременно, а мозаично, по-видимому, в областях наиболее высокой концентрации ЛПС. Из-за этой мозаичности невозможно определить область наибольшего повреждения эндотелия, а, следовательно, точно прогнозировать топику и степень поражения органов.
Экспрессия молекул адгезии в сочетании с синтезом фактора активации тромбоцитов сопровождается активацией тромбоцитов в области открытых плотных межклеточных контактов, их адгезией, выделением прокоагулянтов и формированием на поверхности эндотелия областей диссеминированного внутрисосудистого свертывания. Прикрытие областей межэпителиальных клеточных контактов массой агрегированных тромбоцитов и сгустков нарушает процесс массообмена между капиллярами и подлежащими тканями, формируя условия для развития тканевой гипоксии и повреждения функциональных клеток различных органов, что является основой развития синдрома полиорганной недостаточности (СПОН).
Высокая актуальность проблемы сепсиса продиктовала необходимость проведения в 1991 г. в США совместной конференции обществ торакальных хирургов и специалистов в области интенсивной терапии в целях уточнения определения сепсиса. На конференции было принято согласованное решение по поводу классификации сепсиса, оказавшееся важным фактором унификации определения сепсиса. Было предложено отказаться от многочисленных классификаций, основанных на таких признаках, как область входных ворот, наличие или отсутствие бактериемии и гнойных очагов. Разработка универсального определения сепсиса позволила однотипно проводить регистрацию случаев этого заболевания, систематически оценивать эффективность новых методов диагностики и лечения. Новая классификация сепсиса не имела под собой строгого патофизиологического обоснования, а явилась итогом обсуждения данной проблемы специалистами в виде договора об описательном характере классификации. Современный вариант классификации сепсиса основывается на клиническом определении септических синдромов. К ним относятся:
— генерализованная воспалительная реакция (ГВР) (в английском варианте SIRS — синдром системной воспалительной реакции), которая характеризуется несколькими признаками:
Термин “генерализованная воспалительная реакция” наиболее адекватно отражает английское понятие SIRS. ГВР регистрировали у 40—70% пациентов отделений реанимации и интенсивной терапии, летальность составила 6—7%. Сам по себе этот синдром может быть не связан с инфекционным заболеванием. Он может возникать у пациентов с ожогами, травмами, при хирургическом вмешательстве и т.д.;
— сепсис, подразумевающий наличие ГВР и документированной инфекции. В первом варианте определения сепсиса под “документированной инфекцией” подразумевалась позитивная гемокультура. Через несколько лет стало понятно, что по различным причинам не у всех больных с сепсисом можно выделить возбудителя из крови, и понятие “документированная инфекция” превратилось в понятие “наличие клинических признаков инфекции”. То есть сочетание ГВР и инфекции позволяет диагностировать сепсис. Согласно этому определению сепсис диагностируют примерно у 10% пациентов отделений реанимации и интенсивной терапии;
— тяжелый сепсис, то есть сепсис (ГВР и документированная инфекция) в сочетании с органной дисфункцией или недостаточностью. Он выявляется у 6% пациентов отделений реанимации и интенсивной терапии;
— септический шок — это тяжелый сепсис (ГВР и документированная инфекция в сочетании с органной дисфункцией или недостаточностью) в сочетании с артериальной гипотензией. Он развивается примерно у 2—3% пациентов отделений реанимации. Летальность при этой патологии составляет около 50%, а при абдоминальном сепсисе — 72%.
Важным для клинической практики является выделение пациентов с сепсисом, у которых нет органной дисфункции. Больные этой группы не нуждаются в лечении в условиях отделения реанимации и интенсивной терапии. Они могут получать лечение в профильном отделении стационара: хирургическом, терапевтическом, инфекционном или каком-либо другом. Если нет органной дисфункции, отсутствует и непосредственная угроза смерти. Поэтому в данной группе пациентов основной проблемой диагностики и лечения является возможное выявление и устранение причины, вызвавшей сепсис: определение возбудителя и подбор адекватной антибактериальной терапии.
Во второй половине 90-х годов классификация была дополнена. В нее были включены два важных события, предшествующие сепсису: колонизация и инфекция (таблица). Колонизация и инфекция органично вписываются в структуру сепсиса, указывая, что сепсис является непосредственным продолжением уже имеющегося взаимодействия между размножающимся микроорганизмом и пытающимся защитить себя макроорганизмом. Процесс колонизации, как правило, не сопровождается какими-либо клиническими проявлениями, а процесс инфекции может с самого начала иметь лавинообразный характер, когда отсутствует четкая грань между инфекцией и сепсисом, например, у пациентов с фульминантной менингококкцемией. Другим вариантом может быть наличие клинических признаков инфекции, например, инфицированной раневой поверхности или пиелонефрита, на протяжении продолжительного периода времени, а развитие сепсиса приводит к новым клиническим проявлениям и резкому утяжелению состояния пациента, так что граница между инфекцией и сепсисом может быть ретроспективно распознана достаточно определенно.
Дополнения к классификации сепсиса
| Колонизация | МБС |
| Инфекция | МБС + МВР |
| Сепсис | МБС + ГВР |
| Тяжелый сепсис | МБС + ГВР + СПОН |
| Септический шок | МБС + ГВР + СПОН + гипотензия |
Примечание. МБС — микробиологическое событие; МВР — местная воспалительная реакция.
Процесс колонизации определяется наличием внутренних и внешних факторов. К внутренним относятся стресс, изменение биоценоза кожи и кишечника, нарушение целостности кожи и слизистых оболочек; к внешним — патогенность окружающей флоры, наличие факторов вирулентности, позволяющих микроорганизмам выживать в неблагоприятных условиях. В случае госпитализации, например, для планового оперативного лечения, в период пребывания в больнице у пациента происходит постепенная смена обычной внебольничной флоры на внутрибольничную, так как именно эта флора лучше адаптирована к выживанию в данных конкретных условиях. Особенно важно это учитывать при развитии нозокомиальных или внутрибольничных инфекций. Опасность процесса колонизации заключается в постоянно возрастающем увеличении массы микроорганизмов и постоянной потенциальной опасности развития инфекции в результате любого, даже незначительного, снижения реактивности организма человека.
Инфекции в широком смысле слова — это многообразие инфекционных заболеваний и инфекционных осложнений соматических заболеваний. Патогенез инфекционных болезней связан с размножением возбудителей заболевания (МБС) и развитием МВР, направленной на ограничение распространения инфекции. В случае невозможности контроля инфекционного процесса местным воспалением возникает ГВР. Таким образом, сепсис — это ГВР с клиническими признаками инфекционного заболевания, тяжелый сепсис — это сепсис с появлением признаков СПОН, а септический шок — тяжелый сепсис в сочетании с артериальной гипотензией.
Представленная классификация сепсиса является схематичной и упрощенной, она не может объяснить всего многообразия тяжелых инфекций. Тем не менее, ее использование позволяет единообразно подходить к выбору диагностических критериев сепсиса у больных с различными инфекциями, регистрации случаев сепсиса, проведению сравнительных исследований эффективности различных методов лечения больных с этой патологией. Выработанный подход к классификации связан с отсутствием единой научной концепции, позволяющей определять алгоритм патогенеза и лечения сепсиса.
Важным шагом вперед является описание критериев отдельных видов полиорганной недостаточности. Необходимо отметить, что эти критерии различаются у пациентов с тяжелым сепсисом и септическим шоком, за исключением ДВС-синдрома. Это связано с тем, что у пациентов с септическим шоком заболевание протекает в более тяжелой форме, и для них характерны более тяжелые проявления СПОН.
Критерии СПОН при тяжелом сепсисе
Примечание. FiO2 — концентрация кислорода во вдыхаемом воздухе. В атмосферном воздухе FiO2 = 0,21, то есть 21% кислорода. При ИВЛ этот показатель может быть увеличен в контуре аппарата до 100%.
BE — мера избытка нелетучих кислот или щелочей в крови; нормальные показатели от –3 до +3 ммоль/л. ВЕ используется для оценки степени метаболического ацидоза или алкалоза и расчета необходимой дозы гидрокарбоната для коррекции ацидоза.
АЧТВ — активированное частичное тромбопластиновое время.
ПДФ — продукты деградации фибриногена.
Критерии СПОН при септическом шоке
Примечание. АД — артериальное давление.
АлАТ — аланиновая аминотрасфераза.
ПДКВ — постоянное положительное давление в конце выдоха. Это давление создается в контуре аппарата и дыхательных путях пациента в конце выдоха для увеличения объема открытых альвеол в целях улучшения газообмена при респираторном дистресс-синдроме у взрослых.
Необходимо подчеркнуть подробное количественное описание каждого вида органной недостаточности, возникающего при сепсисе и септическом шоке. Выявление признаков СПОН в таком виде не представляет большой сложности. Поэтому использование этой классификации позволит как определять степень тяжести состояния отдельных пациентов, так и выделять группы больных с аналогичными синдромами, сравнивать их между собой для оценки, например, эффективности новых методов лечения. Этот подход позволяет формировать одинаковые по тяжести состояния группы больных с сепсисом и септическим шоком. Унификация оценки тяжести состояния больных позволит проводить многоцентровые исследования у пациентов с сепсисом.
Принципы лечения тяжелого сепсиса и септического шока заключаются в:
Исход лечения пациентов с сепсисом во многом определяется эффективностью противомикробной терапии. Причем эффективная противомикробная терапия, в случае своевременного ее начала, позволяет у ряда пациентов остановить инфекционный процесс на стадии сепсиса, то есть предотвратить развитие полиорганной недостаточности — основной причины смерти пациентов с сепсисом. У больных с тяжелым сепсисом и септическим шоком высокая эффективность противомикробной терапии становится жизненно необходимой. И только у пациентов с септическим шоком, находящихся в очень тяжелом состоянии, смерть которых наступает раньше, чем через двое суток после начала антибактериальной терапии, эффективность антибактериального лечения оценить очень трудно. Эффект антибактериальной терапии можно определить с некоторым запозданием вследствие “инерции” инфекционного процесса, которая связана с биологическими особенностями роста различных бактерий, значительной микробной массой, наличием резистентной флоры и другими объективными причинами.
В случае тяжелого состояния больного с сепсисом антибактериальную терапию начинают эмпирически. Эмпирическая терапия предполагает выбор противомикробного препарата или их комбинации с учетом наиболее вероятного в данной ситуации возбудителя заболевания. Эффективность эмпирической терапии существенно повышается при наличии данных мониторинга микробной флоры и ее резистентности к антибиотикам в конкретном стационаре. При отсутствии таких данных необходимо использовать данные, полученные отечественными учеными или данные мировой литературы, однако в последнем случае они имеют больше информативный, чем практический интерес. Важными критериями выбора препаратов являются их способность к проникновению в очаг воспаления, наличие достоверных доказательств их клинической эффективности в конкретной клинической ситуации, выбор режима дозирования и способа их введения. Терапию сепсиса можно проводить одним препаратом (монотерапия) или их комбинацией. Выбор монотерапии или комбинации препаратов зависит, с одной стороны, от предполагаемой этиологии заболевания, вероятности полимикробной инфекции, резистентности флоры, с другой — от противомикробного спектра выбранного препарата или комбинации препаратов.
При эмпирической монотерапии острого терапевтического и хирургического нозокомиального сепсиса наиболее часто используют карбапенемы. Это связано с ультрашироким спектром противомикробной активности этих препаратов (грамположительные, грамотрицательные аэробы и анаэробы, за исключением метициллинорезистентных стафилококков и B. fragilis) и быстрым наступлением бактерицидного эффекта. В случае внебольничного так называемого “терапевтического” сепсиса (внебольничный сепсис, подострый бактериальный эндокардит, инфекции кожи и мягких тканей) в случае отсутствия СПОН очень высока вероятность выявления грамположительной флоры (стафилококки, стрептококки, энтерококки). В этих случаях монотерапию можно проводить полусинтетическими пенициллинами, защищенными пенициллинами (сочетание пенициллинов с ингибиторами b -лактамаз), цефалоспоринами I и IV поколения.
Комбинированная терапия сепсиса предполагает сочетание препаратов, относящихся к группам цефалоспоринов III и IV поколения, гликопептидов, аминогликозидов и метронидазола. Выбор комбинированной терапии чаще всего зависит от спектра возможных возбудителей и конкретной клинической ситуации. В случае тяжелого сепсиса с наличием признаков СПОН (нозокомиальный сепсис, острый бактериальный эндокардит, абдоминальный сепсис, уросепсис) возможна монотерапия имипенемом (внутривенно), либо комбинированная терапия цефалоспоринами III и IV поколения в сочетании с аминогликозидами. Высокая вероятность участия в патогенезе абдоминального сепсиса B. fragilis приводит к необходимости добавления к указанной комбинации метронидазола. В случае лечения пациентов, которые уже получали моно- или комбинированную антибактериальную терапию карбапенемами, цефалоспоринами III и IV поколения, необходимо обсудить целесообразность назначения ванкомицина (высокая вероятность участия в патогенезе заболевания метициллинорезистентных стафилококков).
При нейтропении эмпирическую монотерапию сепсиса рекомендуют проводить только имипенемом (внутривенная инфузия по 500 мг 4 раза в сутки), а комбинированную — цефтазидимом (внутривенно 2 г через 8 ч) в сочетании с амикацином (внутривенная инфузия по 15 мг/кг 1 раз в сутки или 7,5 мг/кг 2 раза в сутки).
Еще раз необходимо остановиться на использовании результатов бактериологического исследования у пациентов с сепсисом. Многие клиницисты сетуют на то, что данные микробиологического исследования можно получить слишком поздно — когда пациент уже поправляется, либо — умер. Необходимо помнить, что микробиологическое исследование предполагает повторные посевы с целью выделения и идентификации чистой культуры. “Заставить” микроорганизмы расти быстрее, чем они это делают — невозможно. Для клиницистов важным является обязательный сбор микробиологической информации (вид инфекции, этиология, чувствительность возбудителя к антибиотикам), полученной у отдельных пациентов, ее систематизация и анализ. Систематический анализ образцов выделенной от больных флоры с учетом ее антибиотикорезистентности значительно повысит эффективность эмпирической противомикробной терапии в конкретном клиническом отделении.
Интенсивная терапия является важным компонентом лечения больных с сепсисом. Необходимо помнить, что в первые несколько суток при тяжелом сепсисе и септическом шоке инфузионную терапию проводят на фоне повышенной проницаемости сосудов. Поэтому сбалансированность применения коллоидных и кристаллоидных препаратов является обязательным условием лечения — во избежание избыточной гидратации интерстициального пространства и усугубления органной недостаточности. Применение осмодиуретиков может сопровождаться их попаданием в интерстициальное пространство и увеличивать его объем, что будет препятствовать нормальному массопереносу между капиллярами и клетками органов, усиливать органную недостаточность. Применение салуретиков существенным образом может уменьшить интерстициальный отек тканей, улучшить газообмен, однако требует мониторинга волемического статуса из-за реальной опасности снижения объема циркулирующей крови. Необходимость применения инотропной поддержки у пациентов с сепсисом считается общепринятой. Препараты, обычно используемые для этой цели (допамин, добутамин, норадреналин), обладают выраженным дозозависимым эффектом, поэтому их следует точно дозировать с помощью специальных перфузоров. Также целесообразно проводить мониторирование центральной гемодинамики (ЦГД) и желудочную тонометрию. Мониторирование ЦГД включает инвазивное/неинвазивное определение уровня АД, ЧСС, ударного объема, сердечного индекса, периферического сосудистого сопротивления, центрального венозного давления, давления заклинивания легочной артерии и некоторых других показателей. Желудочная тонометрия — метод определения рН слизистой оболочки желудка. Его применяют для оценки адекватности кровообращения — кровоснабжения слизистой оболочки желудка и тонкого кишечника.
ИВЛ является методом патогенетического лечения респираторного дистресс-синдрома, одной из важнейших причин острой дыхательной недостаточности у больных с сепсисом. Эффективность проведения этого метода лечения в значительной степени зависит от технических возможностей аппарата, с помощью которого проводят ИВЛ. Для обеспечения определенного приемлемого технического уровня проведения ИВЛ необходимо использовать аппараты, способные обеспечивать, кроме вентиляции по объему, вентиляцию по давлению с изменением соотношения продолжительности вдоха и выдоха, мониторинга сопротивления дыхательных путей и податливости легочной ткани в реальном времени, а также ряда других параметров.
Принципы интенсивной терапии с применением ИВЛ
Примечание. ARDS (adult respiratory distress syndrome) — респираторный дистресс-синдром у взрослых.
PEEP (positive end-expiratory pressure) — постоянное положительное давление в конце выдоха.
СРАР (continuous positive airway pressure) — метод ИВЛ, позволяющий снижать пиковое давление дыхательного цикла. Применяют при тяжелой дыхательной недостаточности; в отечественной литературе называют ИВЛ по давлению.
ЭКМО — экстракорпоральная мембранная оксигенация крови — метод внелегочной оксигенации крови. Применялся как дополнительная мера улучшения газообмена при тяжелом поражении паренхимы легких в результате ARDS.
Очень важным компонентом терапии СПОН является продленная гемофильтрация. Этот метод лечения позволяет контролировать волемический статус пациента и объем интерстициальной жидкости. Большие объемы массообмена (20—30 л полиэлектролитных растворов в сутки) позволяют выводить продукты обмена не только из циркулирующей крови, но и из интерстициального и внутриклеточного сектора и замещать нарушенную функцию почек и печени. Недавно появились клинические данные, указывающие, что с помощью этого метода можно удалить значительное количество провоспалительных цитокинов.
Кроме ИВЛ, у больных с сепсисом имеется определенный опыт применения экстракорпоральной мембранной оксигенации в целях коррекции гипоксемии. Было показано, что применение этого метода у пациентов с септическим шоком и тяжелой острой дыхательной недостаточностью не привело к снижению летальности.
Применение препаратов, способных существенно влиять на интенсивность воспаления, имеет уже определенный исторический интерес. В нескольких крупных контролируемых исследованиях, посвященных изучению эффективности глюкокортикостероидных гормонов, не было показано улучшения результатов лечения сепсиса или его исходов. Применение различных антител, способных связывать эндотоксин грамотрицательных бактерий у больных с сепсисом, также не привело к снижению летальности.
Принципы интенсивной терапии с применением модуляторов воспаления
Примечание. АТ к ЭТ — антитела к эндотоксину.
МК IgM — моноклональные антитела класса IgМ, HA-1А — название антительного препарата, полученного на гибридоме клеток человека.
E5 — моноклональные антитела класса IgМ, E5 — название антительного препарата, полученного на гибридоме клеток мыши.
АТ к ФНО – антитела к фактору некроза опухолей.
ИЛ1 – интерлейкин-1.
PAF – рецепторный антагонист фактора активации тромбоцитов
Применение антител к фактору некроза опухолей и растворимого рецептора интерлейкина-1 также не приводило к снижению летальности больных с сепсисом.
Антиоксиданты, простагландины и блокаторы синтеза простагландинов — ингибиторы метаболизма арахидоновых кислот, рецепторный антагонист фактора активации тромбоцитов, искусственный сурфактант, ингибитор синтеза оксида азота — все эти препараты были всесторонне исследованы в клинических условиях, их применение также не привело к снижению летальности у пациентов с сепсисом.
Существенным дополнением к известным патогенетическим механизмам развития сепсиса являются новые данные о способности ЛПС грамотрицательных бактерий активировать клетки. Молекула ЛПС воспринимается клетками организма как сигнал к активации иммунологического ответа, что отмечается при развитии большинства инфекций, вызванных грамотрицательными микроорганизмами. Важную роль в понимании сигнального значения ЛПС играют экспериментальные исследования на мышах линии C3H/HeJ. Эти мыши, обладая низкой чувствительностью к ЛПС, вводимому парентерально, очень чувствительны к внутривенному введению живых бактерий того же вида, из которых был получен ЛПС. Уже давно известна способность макрофагов в ответ на действие ЛПС синтезировать провоспалительные цитокины (ФНО и ИЛ1). Однако оставалось неясным, каким образом ЛПС осуществляет передачу информации макрофагам о необходимости включения синтеза цитокинов. Было обнаружено, что гипореактивность мышей линии C3H/HeJ связана с мутацией в небольшой части ДНК хромосомы 4 в области между двумя уже известными маркерами. Эти мутации локализованы в области гена, ответственного за синтез определенного рецептора (Toll-like receptor-4 — Tlr-4). Известно, что именно этот ген активирует ген, кодирующий образование дрозомицина — вещества, определяющего устойчивость к грибковой инфекции дрозофил. У человека полиморфизм этого гена обнаружен у представителей различных рас. Предполагается, что именно мутации этого гена могут быть генетической основой различного ответа на инфекцию, вызванную грамотрицательными микроорганизмами, у разных пациентов.
Существует вариант антигенов главного комплекса гистосовместимости тканей (HLA-A1-B8-DR3), при наличии которого у пациентов с хантавирусной инфекцией отмечается высокая проницаемость капилляров, значительная инфильтрация CD8+ Т-клетками, высокий уровень экспрессии молекул адгезии (ICAM-1), фактора некроза опухоли-альфа и трансформирующих ростковых факторов. Несмотря на то, что хантавирусная инфекция обычно протекает без клинических проявлений или со слабовыраженными симптомами воспаления, у 10% пациентов, имеющих гены HLA-A1-B8-DR3, развивается шок, у 5% — почечная недостаточность, требующая проведения гемодиализа, некоторые больные умирают (1%). У пациентов с генотипом HLA-B27 отмечаются незначительно выраженные клинические симптомы. Предполагается, что гаплотип HLA-A1-B8-DR3 отражает особый тип ГВР на инфекцию.
Таким образом, результаты современных исследований позволяют говорить о наличии определенных генетических факторов, способных оказывать существенное влияние на интенсивность генерализованного воспаления и, следовательно, на клинические проявления и исход заболевания.
В заключение необходимо отметить, что проблема сепсиса на сегодняшний день решена только отчасти. Основными принципиальными задачами являются унификация определения сепсиса, СПОН и разработка новых патогенетических и лечебных концепций.
В идеале решение проблемы лечения сепсиса должно идти по следующим направлениям: